OPUS -20 Narodowe Centrum Nauki
Tytuł projektu:
Dostarczanie immunologicznych-aktywatorów do komórek fagocytujących w celu uzyskania odpowiedzi przeciwnowotworowej.
Konsorcjum: Warszawki Uniwersytet Medyczny, Politechnika Wrocławska
Kierownik projektu PWr: dr hab. Magdalena Przybyło
Okres realizacji: 2022 – 2026
Streszczenie: Nowotwory są złożonymi tworami składającymi się z różnych komórek. Główna populacja komórkowa to ztransformowane komórki rakowe, ale pozostałe to komórki mikrośrodowiska nowotworu. Kompozycja komórkowa mikrośrodowiska guza, szczególnie poprzez działanie nowotworowych komórek odpornościowych, wpływa na efektywność terapii przeciwnowotworowej.
W ostatnich latach obserwujemy bezprecedensowy sukces kliniczny terapii immunologicznych, np. za pomocą inhibitorów punktów kontrolnych lub limfocytów T z chimerycznymi receptorami antygenowymi. Jednak wielu pacjentów z nowotworem wykazuje oporność na immunoterapię. Oporność ta jest powodowana przez niekorzystne, immunosupresyjne mikrośrodowisko guza, szczególnie przez makrofagi, monocyty i hamujące komórki dendrytyczne. Aktywacja i przeprogramowanie komórek odpornościowych zrębu nowotworu, może umożliwić skuteczną odpowiedź immunologiczną i terapię np. przez inhibitory punktów kontrolnych.
Celem tego projektu jest zbadanie optymalnego mechanizmu, który może aktywować makrofagi, aby ułatwić odpowiedź przeciwnowotworową. Planujemy to osiągnąć poprzez stymulację prozapalnych ścieżek sygnalizacyjnych, które normalnie są aktywowane przez patogeny podczas infekcji. Będziemy stymulować immuno-aktywujące szlaki sygnalne TLR lub STING w makrofagach wewnątrznowotworowych. Umożliwi to przeprogramowanie ich funkcji z pro- na przeciw-nowotworowe. W tym celu wykorzystamy liposomowe nośniki zawierające związki aktywujące TLR lub STING. Badania będą prowadzone w hodowlach komórek pierwotnych i linii nowotworowych jak i mysich modelach nowotworowych. Ostatecznie zbadamy efektywność dostarczania ww. związków do fagocytów i zmiany aktywacji makrofagów wewnątrznowotworowych, co będzie miało umożliwić zahamowanie wzrostu nowotworów u mysich pacjentów.
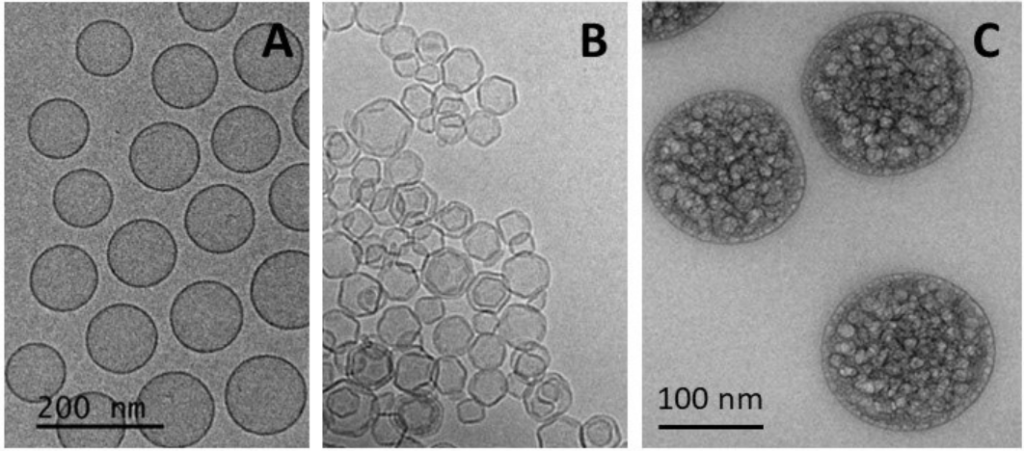
Figure 1. Cryogenic transmission electron microscopy (cryo-TEM) images of our liposomes formed from phosphatidylcholines in the fluid phase (A.) and liposomes formed from DPPC in the gel phase (B.) (in press) (C) Liposomes formed from PC in high condensed gel technology encapsulating PVP-chlorine polymers (SEM).
